Бензол. Химические свойства
Бензольное ядро довольно устойчиво. Оно более склонно к реакциям замещения атомов водорода бензольного кольца, нежели к реакциям присоединения по месту разрыва двойных связей. В этом выражении его «ароматический характер».
Реакции замещения
Наиболее характерны реакции электрофильного замещения: нитрирование, сульфирование, алкилирование (ацилирование), галогенирование (галогенирование гомологов бензола может идти и по радикальному механизму.
1. Нитрование - замещение водорода бензольного кольца нитрогруппой - проводят так называемой нитрирующей смесью - смесью концентрированных азотной и серной кислот. Действующим агентом является катион нитрония N0 2 + :
НО - N0 2 + 2H 2 S0 4 →N0 2 + + 2HS0 4 - + H 3 0
Нитроний катион гидроксоний катион
Механизм нитрования (как и всех реакций замещения) следующий:
Присутствие воды в реакционной смеси мешает течению реакции, т.к. вода участвует в процессе, обратном образованию катиона нитрония. Поэтому для связывания выделяющейся в реакции воды берут избыток концентрированной серной кислоты.
Правила замещения водородов бензольного ядра. Если в бензольном ядре имеется какой-нибудь заместитель водорода, то в реакциях электрофильного замещения он играет роль ориентанта - реакция идет преимущественно в орто- и пара-положения по отношению к заместителю (ориентант I рода) или в мета-положения (ориентант II рода).
Заместители I рода направляют атакующий электрофил в орто- и пара-положения по отношению к себе. Приводим их в порядке убывания ориентирующей силы (электродонорного эффекта):
Заместители II рода направляют атакующий электрофил в мета-положения по отношению к себе. Приводим их также в порядке убывания ориентирующей силы:
Например, -ОН - группа - ориентант I рода:


59. Напишите уравнение и механизм реакций нитрования следующих соединений: а) бензол; б) толуол; в) хлорбензол; г) нитробензол; д) сульфобензол; е) цианистый фенил; ж) метоксибензол; з) аминобензол.

Заместители I рода являются электродонорными, они увеличивают плотность электронного облака бензольного ядра, особенно в орто- и пара-положениях и тем самым (облегчают) активируют бензольное ядро к атаке электрофила. Однако σ-комплекс (III) стабилизируется не присоединением аниона, а отщеплением катиона водорода (энергия, выделяющаяся при образовании единого π-электронного облака бензольного ядра, 36,6 ккал/моль):

Заместители II рода являются электроноакцепторными, они как бы оттягивают на себя часть электронного облака, тем самым уменьшают плотность электронного облака бензольного ядра, особенно в орто- и пара-положениях по отношению к себе. Заместители II рода в общем-то затрудняют реакции электрофильного замещения. Но в мета-положениях по отношению к заместителю II рода плотность облака несколько выше, чем в других. Поэтому реакции электрофильного замещения в случае заместителей II рода идут в мета-положения:
 |

Описанные выше правила не носят характера законов. Речь почти всегда идет только о главном направлении реакции. Например, при нитровании толуола образуется 62 % орто-, 33,5 % пара- и 4,5 % мета-нитротолуолов.
Довольно сильное влияние на направления реакций оказывают условия проведения (температура, присутствие катализаторов и др.).
При наличии двух ориентантов в бензольном ядре возможна согласованная и несогласованная ориентация этих двух заместителей. В случае несогласованной ориентации заместителей одного рода направление реакции определяет более сильный (см. ряды заместителей I и II рода):

В случае несогласованной ориентации заместителей разного типа направление реакции определяет заместитель I рода, так как он активирует бензольное ядро к электрофильной атаке, например,

60. Согласно правилам замещения, напишите нитрование следующих двузамещенных бензола: а) м-нитротолуола; б) п-нитротолуола; в) о-окситолуола; г) п-хлортолуола; д) м-нитробензойной кислоты; е) п-оксихлорбензола; ж) м-хлортолуола; з) п-метокситолуола.
2. Реакция сульфирования протекает при нагревании аренов с концентрированной серной кислотой или олеумом. Атакующим агентом является молекула SO 3 , играющая роль электрофила:

Первая стадия сульфирования - медленная, реакция в целом обратимая:

Сульфокислоты по силе сравнимы с минеральными, поэтому в водных растворах они находятся в ионизированном состоянии (III).
61. Приведите уравнения и механизмы реакций сульфирования следующих веществ, придерживаясь правил замещения:
а) толуола; б) о-ксилола; в) нитробензола; г) о-нитротолуола; д) п-хлорнитробензола; е) м-нитротолуола; ж) п-аминотолуола; з) о метокситолуола.
3. Реакция галогенирования
аренов на холод в присутствии катализаторов типа AlCl 3 , AlBr 3 , FeCl 3 - типичная электрофильная реакция, ибо катализаторы способствуют поляризации связи в молекуле галогена (вплоть до ее разрыва): 
Таким же образом действует и безводное хлорное железо:

В условиях радикальной реакции (свет, нагревание) галогены (хлор, бром) замещают водороды боковых цепей (аналогично галогенированию алканов):

В более жестких условиях происходит и радикальное присоединение галогенов к ароматическому ядру.
62 . Напишите уравнения и механизмы реакции и назовите продукты:
а) толуол + хлор (при ярком свете и нагревании);
б) толуол + хлор (на холоду в присутствии катализатора);
в) нитробензол + хлор (на холоду в присутствии катализатора);
г) п-нитротолуол + хлор (при ярком свете и нагревании);
д) п-нитротолуол + хлор (на холоду в присутствии катализатора):
е) этилбензол + хлор (при ярком свете и нагревании);
ж) этилбензол + хлор (на холоду в присутствии катализатора);
з) п-окситолуол + хлор (на холоду в присутствии катализатора);
и) м-нитротолуол + хлор (на холоду в присутствии катализатора);
к) м-ксилол + хлор (на холоду в присутствии катализатора).
4. Алкилирование аренов. В присутствии безводного AlCl 3 (А1Вrз) галогеналканы алкилируют бензол, еще легче, чем его гомологи, а также их галогенпроизводные (реакции Густавсона-Фриделя-Крафтса). Катализатор, образуя комплекс А1Сl 3 , поляризует связь С-Гал вплоть до разрыва ее, и поэтому атакующий агент-электрофил:

Алкилирование алкенами в присутствии А1Сl 3 , BF 3 или Н 3 РО 4 приводит к аналогичным результатам (механизм тоже электрофильный):


Алкилирование галогеналканами и алкенами как электрофильные реакции идут в соответствии с правилами замещения водородов бензольного кольца. Однако процесс осложняется дальнейшим алкилированием продуктов реакции и другими нежелательными явлениями. Чтобы последние свести к минимуму, реакцию ведут при возможно низкой температуре, оптимальном количестве катализатора и большом избытке арена.
63. Приведите уравнения и механизм реакций в условиях Густавсона-Фриделя-Крафтса между следующими веществами:
а) бензол + 2-хлорпропан; б) бензол + 2-хлор-2-мегилпропан; в) бензол + бензилхлорид; г) бромбензол + бромэтан; д) толуол + бутилхлорид; е) толуол + бромэтан; и) п-бромтолуол + изопропилбромид; з) м-бромтолуол + бромэтан; и) п-бромтолуол + изопропилбромид; к) хлорбензол + бензилхлорид.
64. Напишите уравнения реакций алкилирования аренов алкенами в присутствии фосфорной кислоты, приведите механизм:
а) бензол + этилен; б) бензол + пропилен; в) толуол + этилен; г) толуол + пропилен; д) бензол + изобутилен; е) толуол + изобутилен; ж) м-ксилол + этилен; з) п-ксилол + этилен.
5. Реакция окисления (определение числа боковых цепей). Ароматическое ядро очень устойчиво к окислителям. Так, бензол и его гомологи не реагируют с перманганатом калия подобно алканам. В этом тоже выражается их «ароматический характер». Но при нагревании гомологов бензола с окислителями в жестких условиях бензольное ядро не окисляется, а все боковые углеводородные цепи, независимо от их длины, окисляются до карбоксильных групп, продуктами окисления являются ароматические кислоты. По количеству карбоксильных групп в последних судят о числе боковых цепей в исходном гомологе бензола 1 .

65 . Напишите уравнения реакций окисления следующих веществ: а) этилбензол; б) о-диметилбензол; в) пропилбензол; г) рядовой триметилбензол; д) п-метилизопропилбензол; е) о-нитротолуол; ж) 3-нитро-1-метил-4-этилбензол; з) симметричный триметилбензол.
6. Реакции присоединения. Хотя ароматическое ядро менее склонно к реакциям присоединения, чем замещения, в некоторых условиях они имеют место. Особенностью реакций присоединения является то, что к одному молю бензола (или его гомолога) всегда присоединяется по три моля галогена, водорода, озона, что объясняется наличием у ароматического ядра единого π-электронного облака с определенной единой, общей энергией трех двойных связей (вернее, шести π-электронов).
а) Гидрирование идет в присутствии катализаторов (Pt, Pd и др.) при 110°С (Н.Д. Зелинский и др.).

б) Галогенирование идет при пропускании паров брома или хлора через кипящий бензол под действием прямого солнечного света или при освещении УФ-лучами (кварцевая лампа):

в) Озонирование. Подобно алкенам ароматические углеводороды легко подвергаются озонолизу.

66. Напишите уравнения реакций присоединения (гидрирования, галогенирования при освещении УФ-лучами, озонирования) со следующими аренами: а) толуол; б) о-ксилол; в) м-ксилол; г) п-ксилол; д) этилбензол; е) о-этилтолуол; ж) м-этилтолуол; з) п-изопропилтолуол. Назовите полученные продукты.
Среди разнообразных реакций, в которые вступают ароматические соединения с участием бензольного кольца, в первую очередь обращают на себя внимание рассмотренные выше реакции замещения. Это происходит, потому что они протекают вопреки ожиданиям. При той степени ненасыщенности, которая присуща, например, бензолу, этому углеводороду более характерными должны были быть реакции присоединения. При определенных условиях так и происходит, бензол и другие арены присоединяют водородные атомы, галогены, озон и другие способные присоединяться реагенты.
11.5.5. Гидрирование. В присутствии катализаторов гидрирования (платина, палладий, никель) бензол и его гомологи присоединяют водород и превращаются в соответствующие циклогексаны. Так, бензол гидрируется над никелевым катализатором при 100-200 0 C и 105 атм.:
Гидрирование аренов по сравнению с алкенами имеет две особенности. Во-первых, арены значительно уступают алкенам в реакционной способности . Для сравнения с условиями гидрирования бензола укажем, что циклогексен гидрируется в циклогексан уже при 25 0 C и давлении в 1,4 атм. Во-вторых, бензол или не присоединяет, или присоединяет сразу три молекулы водорода . Получить гидрированием бензола продукты частичного гидрирования, такие как циклогексен или циклогексадиен, не удается.
Эти особенности при гидрировании, частном случае реакций присоединения к бензольному кольцу, обусловлены строением бензола. При превращении в циклогексан бензол перестает быть ароматической системой. Циклогексан содержит на 150,73 кДж энергии больше (энергия резонанса) и менее устойчив, чем бензол. Понятно, что перейти в это термодинамически менее устойчивое состояние бензол не склонен. Этим и объясняется меньшая реакционная способность бензола по отношению к водороду по сравнению с алкенами. Присоединение к ароматической системе возможно лишь с участием р -электронов единого электронного облака бензольного кольца. С началом процесса присоединения система перестает быть ароматической и получается богатая энергией и обладающая высокой реакционной способностью частица, которая гораздо охотнее вступает в реакцию присоединения, чем исходный арен.
11.5.6. Галогенирование. Результат взаимодействия галогена с бензолом зависит от экспериментальных условий. Каталитическое галогенирование ведет к образованию продуктов замещения. Оказалось, что ультрафиолет инициирует присоединение атомов галогена к бензольному ядру аренов. Сам бензол на свету присоединяет 6 атомов хлора и превращается в гесахлорциклогексан, представляющий смесь 9 пространственных изомеров
Один из этих изомеров, в котором 3 хлора занимают аксиальные связи, а еще 3 – экваториальные связи (γ-изомер, гексахлоран), оказался эффективным инсектицидом, средством борьбы с вредными насекомыми. Гексахлоран оказался слишком устойчивым в условиях биосферы и способным накапливаться в жировой ткани теплокровных и поэтому в настоящее время не применяется.
По своей реакционной способности по отношению к галогенам в реакциях присоединения бензол значительно уступает алкенам. Например, хлор и бром в четыреххлористом углероде даже в темноте при комнатной температуре присоединяются к циклогексену. В указанных условиях бензол не реагирует. Происходит это только при ультрафиолетовом освещении.
11.5.7. Озонирование. Озонирование - еще один пример, показывающий, что бензол как ненасыщенное соединение может вступить в реакцию присоединения. Озонирование бензола и изучение продуктов гидролиза триозонида было осуществлено еще в 1904 году (Гарриес )
Интересные результаты были получены при озонировании о -ксилола (1941 г., Вибо ). Дело в том, что состав продуктов озонирования зависит от положения двойных связей в бензольном кольце. Структура 1 с двойными связями между углеродами бензольного кольца, несущими метильные заместители, при озонировании и гидролизе озонида даст 2 молекулы метилглиоксаля и молекулу глиоксаля
Альтернативная структура II для о -ксилола должна была бы образовать 2 молекулы глиоксаля и молекулу диацетила
Первая группа реакций реакции замещения. Мы говорили, что арены не имеют кратных связей в структуре молекулы, а содержат сопряженную систему из шести электронов, которая очень стабильна и придает дополнительную прочность бензольному кольцу. Поэтому в химических реакциях происходит в первую очередь замещение атомов водорода, а не разрушение бензольного кольца.
С реакциями замещения мы уже сталкивались при разговоре об алканах , но для них эти реакции шли по радикальному механизму, а для аренов характерен ионный механизм реакций замещения.
Первое химическое свойство галогенирование. Замещение атома водорода на атом галогена хлора или брома.
Реакция идет при нагревании и обязательно с участием катализатора. В случае с хлором это может быть хлорид алюминия или хлорид железа три. Катализатор поляризует молекулу галогена, в результате чего происходит гетеролитический разрыв связи и получаются ионы.
Положительно заряженный ион хлора и вступает в реакцию с бензолом.
Если реакция происходит с бромом, то катализатором выступает бромид железа три или бромид алюминия.

Важно отметить, что реакция происходит с молекулярным бромом, а не с бромной водой. С бромной водой бензол не реагирует.
У галогенирования гомологов бензола есть свои особенности. В молекуле толуола метильная группа облегчает замещение в кольце, реакционная способность повышается, и реакция идет в более мягких условиях, то есть уже при комнатной температуре.

Важно отметить, что замещение всегда происходит в орто- и пара-положениях, поэтому получается смесь изомеров.
Второе свойство нитрование бензола, введение нитрогруппы в бензольное кольцо.
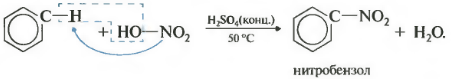
Образуется тяжелая желтоватая жидкость с запахом горького миндаля нитробензол, поэтому реакция может быть качественной на бензол. Для нитрования используется нитрующая смесь концентрированной азотной и серной кислот. Реакция проводится при нагревании.
Напомню, что для нитрования алканов в реакции Коновалова использовалась разбавленная азотная кислота без добавления серной.
При нитровании толуола, также как и при галогенировании, образуется смесь орто- и пара- изомеров.

Третье свойство алкилирование бензола галогеналканами.
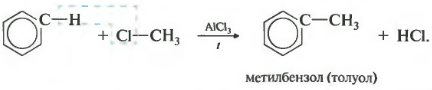
Эта реакция позволяет ввести углеводородный радикал в бензольное кольцо и может считаться способом получения гомологов бензола. В качестве катализатора используется хлорид алюминия, способствующий распаду молекулы галогеналкана на ионы. Также необходимо нагревание.
Четвертое свойство алкилирование бензола алкенами.

Таким способом можно получить, например, кумол или же этилбензол. Катализатор хлорид алюминия.
2. Реакции присоединения к бензолу
Вторая группа реакций реакции присоединения. Мы говорили, что эти реакции не характерны, но они возможны при достаточно жестких условиях с разрушением пи-электронного облака и образованием шести сигма-связей.
Пятое свойство в общем списке гидрирование, присоединение водорода.
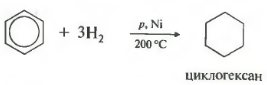
Температура, давление, катализатор никель или платина. Таким же образом способен реагировать толуол.
Шестое свойство хлорирование. Обратите внимание, что речь идет именно о взаимодействии с хлором, поскольку бром в эту реакцию не вступает.

Реакция протекает при жестком ультрафиолетовом облучении. Образуется гексахлорциклогексан, другое название гексахлоран, твердое вещество.
Важно помнить, что для бензола не возможны реакции присоединения галогеноводородов (гидрогалогенирование) и присоединение воды (гидратация).
3. Замещение в боковой цепи гомологов бензола
Третья группа реакций касается только гомологов бензола это замещение в боковой цепи.
Седьмое свойство в общем списке галогенирование по альфа-атому углерода в боковой цепи.

Реакция происходит при нагревании или облучении и всегда только по альфа-углероду. При продолжении галогенирования, второй атом галогена снова встанет в альфа-положение.
4. Окисление гомологов бензола
Четвертая группа реакций окисление.
Бензольное кольцо слишком прочное, поэтому бензол не окисляется перманганатом калия не обесцвечивает его раствор. Это очень важно помнить.
Зато гомологи бензола окисляются подкисленным раствором перманганата калия при нагревании. И это восьмое химическое свойство.
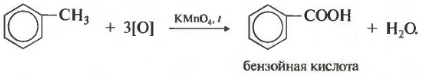
Получается бензойная кислота. Наблюдается обесцвечивание раствора. При этом, какой бы длинной не была углеродная цепь заместителя, всегда происходит ее разрыв после первого атома углерода и альфа-атом окисляется до карбоксильной группы с образованием бензойной кислоты. Оставшаяся часть молекулы окисляется до соответствующий кислоты или, если это только один атом углерода, до углекислого газа.
Если гомолог бензола имеет больше одного углеводородного заместителя у ароматического кольца, то окисление происходит по тем же правилам окисляется углерод, находящийся в альфа-положении.
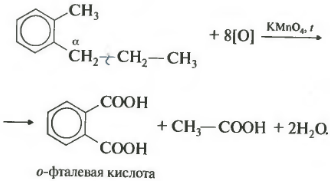
В данном примере получается двухосновная ароматическая кислота, которая называется фталевая кислота.
Особым образом отмечу окисление кумола, изопропилбензола, кислородом воздуха в присутствии серной кислоты.
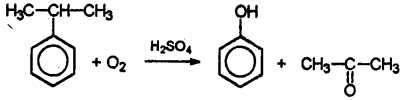
Это так называемый кумольный способ получения фенола. Как правило, сталкиваться с этой реакцией приходится в вопросах, касающихся получения фенола. Это промышленный способ.
Девятое свойство горение, полное окисление кислородом. Бензол и его гомологи сгорают до углекислого газа и воды.
Запишем уравнение горения бензола в общем виде.
По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними. Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле арена, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO 2 . Молекул воды будет в два раза меньше, чем атомов водорода, то есть (2n-6)/2, а значит n-3.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n-3 из воды, итого 3n-3. Слева атомов кислорода столько же 3n-3, а значит молекул в два раза меньше, потому как в состав молекулы входят два атома. То есть (3n-3)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания гомологов бензола в общем виде.
с чем взаимодействует бензол и их уравнения реакции
- аиболее характерны для них реакции замещения атомов водорода бензольного ядра. Они протекают легче, чем у предельных углеводородов. Таким путем получают множество органических соединений. Так, при взаимодействии бензола с бромом (в присутствии катализатора FеВr2) атом водорода замещается атомом брома:
При другом катализаторе можно все атомы водорода в бензоле заместить на галоген. Это происходит, например, при пропускании в бензол хлора в присутствии хлорида алюминия:
Гексахлорбензол - бесцветное кристаллическое вещество, применяемое для протравливания семян и консервирования древесины.
Если на бензол действовать смесью концентрированных азотной и серной кислот (нитрующей смесью) , то атом водорода замещается нитрогруппой NО2:
В молекуле бензола можно заместить атом водорода на алкильный радикал действием галогенопроизводных углеводородов в присутствии хлорида алюминия:
Реакции присоединения к бензолу протекают с большим трудом. Для их протекания необходимы особые условия: повышение температуры и давления, подбор катализатора, световое облучение и др. Так, в присутствии катализатора - никеля или платины - бензол гидрируется, т. е. присоединяет водород, образуя циклогексан:
При ультрафиолетовом облучении бензол присоединяет хлор:
Гексахлорциклогексан, или гексахлоран, - кристаллическое вещество, применяется как сильное средство для уничтожения насекомых.
Бензол не присоединяет галогеноводороды и воду. Он очень устойчив к окислителям. В отличие от непредельных углеводородов он не обесцвечивает бромную воду и раствор KMnO4. В обычных условиях бензольное кольцо не разрушается и при действии многих других окислителей. Однако гомологи бензола подвергаются окислению легче предельных углеводородов. При этом окислению подвергаются лишь радикалы, связанные с бензольным кольцом:
Таким образом, ароматические углеводороды могут вступать как в реакции замещения, так и в реакции присоединения, однако условия этих превращений значительно отличаются от аналогичных превращений предельных и непредельных углеводородов.
Получение. Бензол и его гомологи в больших количествах получают из нефти и каменноугольной смолы, образующейся при сухой перегонке каменного угля (коксовании) . Сухая перегонка производится на коксохимических и газовых заводах.
Реакция превращения циклогексана в бензол (дегидрогенизация или дегидрирование) протекает при пропускании его над катализатором (платиновой чернью) при 300С. Предельные углеводороды реакцией дегидрогенизации также можно превращать в ароматические. Например:
Реакции дегидрирования позволяют использовать углеводороды нефти для получения углеводородов ряда бензола. Они указывают на связь между различными группами углеводородов и на взаимное превращение их друг в друга.
По способу Н. Д. Зелинского и Б. А. Казанского бензол можно получить, пропуская ацетилен через нагретую до 600 С трубку с активированным углем. Весь процесс полимеризации трех молекул ацетилена можно изобразить схемой
- 1)реакция замещения
а) в присутствии катализатора-солей железа (III) - бензол вступает в реакцию замещения:
C6H6+Br2=C6H5Br+Рик
аналогично бензол реагирует и с хлором
б) к реакциям замещения относяться так же взаимодействие бензола с азотной кислотой:
C6H6+HONO2=C6H5NO2+H2O
2)РЕАКЦИЯ ПРИСОЕДИНЕНИЯ
А) при действии солнечного света ли ультрафиолетовых лучей бензол встуает в реакции присоединения. Например, бензол на свету присоединяет хром и образует гексахлорциклогексан:
C6H6+3Cl2=C6H6Cl6
б) бензол способен также гидрироваться:
C6HC+3H2=C6H12
3)РЕАКЦИИ ОКИСЛЕНИЯ
а) при действии энергичных окислителей (КMnO4)на гомологи бензола окислению подвергаються только боковые цепи.
C6H5-CH3+3O=C7H6O2+H2O
б) бензол и его гомологи на воздухе горят пламенем:
2C6H6+15O2=12CO2+6H2O